この記事を読んでわかること ・地図状萎縮(Geographic Atrophy: GA)を伴う加齢黄斑変性(Age-related Macular Degeneration:AMD)に対する期待の新薬Avacincaptad PegolのFDA承認 ・競合品のアメリカでの状況
どうも、こんにちは。
外資系製薬会社経営企画室に勤めるこういちです。
この週末、嬉しいニュースが舞い込んできました。
8月5日にアステラスが8000億円で買収した米国IVERIC BIOの期待の新薬がFDAで承認されました!!
以前に、この買収のことについてはブログでまとめていますので、その記事と合わせてお届けします。
アステラス製薬のプレスリリース

まずはプレスリリースの一部をお届けします。
IZERVAY™(avacincaptad pegol) 地図状萎縮を伴う加齢黄斑変性の治療薬として米国で承認取得
アステラス製薬株式会社 (本社:東京、以下「アステラス製薬 」)は、
地図状萎縮 (Geographic Atrophy: GA)を伴う加齢黄斑変性(Age-related Macular Degeneration: AMD)の治療薬として開発中の IZERVAY™ (一般名:avacincaptad pegol、以下「ACP」) 硝子体内注射液について、
米国食品医薬品局(FDA)から 8 月 4 日(現地時間)に承認を取得しました。
新規補体因子 C5 阻害剤の IZERVAY は唯一、
2 つのピボタル試験 (GATHER1、2 試験)において投与後 12 カ月時点で GA の進行速度を統計学的に有意に抑制することが示され(p<0.01)、FDA から承認されている治療法です。
今回の承認取得は、GA を伴う AMD 患者を対象に、ACP を毎月 2 mg ずつ硝子体内投与し、安全性と有効性を評価した 2 つのピボタル試験(GATHER1、2 試験)の結果に基づいています。
GA の進行速度は、ベースライン、投与から 6 カ月および 12 カ月時点 の GA 病変面積によって評価しました。
両試験における投与後 12 カ月時点での一次解析では、偽処置対照群と比較して、ACP 投与群で GA の進行速度が統計学的に有意に抑制していることが示されました。
GA の進行速度の抑制は、早ければ ACP 投与後 6 カ 月時点で見られ、最初の 1 年間で最大 35%抑制しました。
GA は、米国で約 150 万人に影響を及ぼしています。
しかし、米国で GA を患ってい る人の約 75%は未診断と考えられています。
適切なタイミングでの治療がなければ、 GA 患者の推定 66%が失明または重度の視覚障害になる可能性があります。
GATHER 試験における ACP 2 mg 投与群で投与 12 カ月後に報告された最も一般的な有害事象(発生率 5%以上)は、結膜出血(13%)、眼圧上昇(9%)、かすみ目(8%)でした。
眼圧の上昇は一過性であり、次の診察までに投与前の水準に回復しました。
アステラス製薬は、失明リスクの高い網膜疾患に苦しむ世界中の患者さんのアンメッ トメディカルニーズを満たす新たな治療選択肢を提供していきます。
本件によるアステラス製薬の通期(2024 年 3 月期)連結業績への影響は精査中です。
以上
IZERVAY (avacincaptad pegol:ACP)について
米国における IZERVAY の適応症は、地図状萎縮を伴う加齢黄斑変性です。
この適応症に対して唯一承認さ れている補体因子C5 阻害剤です。
ACP は、欧州でも承認申請中です。
地図状萎縮(Geographic Atrophy: GA)を伴う加齢黄斑変性(Age-related Macular Degeneration: AMD) について
加齢黄斑変性(AMD)は、高齢者における中等度から重度の中心視力低下の主な原因であり、患者さんの大半は両目を侵されています。
黄斑は網膜の中心部にあるわずかな領域で、中心視力をつかさどっています。
AMD が進行すると、黄斑部の網膜色素上皮細胞とその下部にある血管が失われ、網膜組織が著しく薄く なったり、萎縮したりします。
地図状萎縮(GA)を伴うAMDは、患者さんの視力を不可逆的に低下させます。
GATHER 試験について
無作為化二重盲検偽処置対照多施設共同の第 III 相試験である、完了した GATHER1試験および進行中の GATHER2 試験において、ACP は主要評価項目を達成しました。
両試験では、GA を伴う AMD 患者を対象 に、ACP を毎月 2 mg ずつ硝子体内投与した場合の安全性と有効性を評価しました。
両試験とも、最初の 12 カ月間は、毎月 1 回 ACP 2 mg を投与される群と偽処置対照群に無作為に割り付けられました。
GATHER1 試験には 286 人、GATHER2 試験には 448 人が組み入れられました。
両試験の主要評価項目は、ベースライ ン、6 カ月目、12 カ月目の 3 時点における眼底自発蛍光法で測定された GA 面積に基づくものでした。
GATHER 試験では、700 人以上の GA 患者を対象に安全性が評価されました。
アステラス製薬プレスリリース 2023年8月25日より一部抜粋
このプレスリリースを見ればだいたいの概要はつかめますね。
有効性および安全性、ともに認められ、無事FDAから承認を取得しました。
製品名はなんて読むんですかね?
IZERVAY、、、アイザーベイですかね?
IVERIC社に関する前回のブログ
アステラス製薬がIVERIC社の買収を発表したのが2023年5月1日でした。
前回のブログではIVERIC社買収の目的やパイプライン、またGATHER試験1と2の結果(有効性/安全性)について簡単に紹介しています。
ご興味ある方は見てみてください。
前回のブログでお伝えしましたが、FDAによる審査終了目標日(PDUFA data)が2023年8月19日に設定されていました。
なので、そろそろ結果がわかる頃かな~と予想はしていました。
昨日ですかね、
「FDAが承認!!」
というニュースを見たときには、やはり嬉しい気持ちになりましたね。
アステラス製薬が買収したIVERIC社のIZERVAYはミクスでも取り上げられてました
8/7(月)のミクスにも記事になっていました。
記事によると、今後2~4週以内に発売を目指すとのことです。
IVERIC BIOの米国ホームページ

しっかりと製品サイトが作られていました。
米国の添付文書(Prescribing Information)はこちら
情報はまだ少ないですが、製品メッセージとして強調しているメッセージは以下3つですね。

- 12か月以内にGAの進行を最大35%遅らせる
- 網膜細胞死の原因となる視細胞を直接ターゲットにする
- 低い服薬中断率、12か月間の有害事象による中止率は2%未満
こういったメッセージが確認できます。
現在の競合品(C3阻害薬:SYFOVRE®)の状況
実はアステラス製薬/IVERIC BIOには追い風が吹いています。
なぜなら、競合であるC3阻害薬のSYFOVRE®(pegcetacoplan injection)に安全性の懸念が高まっているためです。

ASRS: Six Cases of Occlusive Retinal Vasculitis Reported After Injection of Apellis’ GA Drug Syfovre
Rare cases of retinal vasculitis have occurred after the first injection of Apellis Pharamceuticals’ recently approved geographic atrophy drug Syfovre (pegcetacoplan injection), according to a notification from the ASRS Research and Safety in Therapeutics (ReST) Committee.
The safety concerns, posted online to ASRS members, caused Apellis’s shares to lose about half their value, just 5 months after the targeted C3 therapy became the first FDA approved treatment for GA.
(日本語訳)
ASRS:Apellis社のGA製剤Syfovre注射後に閉塞性網膜血管炎が6例報告される
ASRS Research and Safety in Therapeutics (ReST)委員会からの通知によると、アペリスファーマシューティカルズ社が最近承認した地理的萎縮治療薬サイフォブレ(ペグセタコプラン注射剤)の最初の注射後に、稀に網膜血管炎の症例が発生した。
この安全性に関する懸念はASRSの会員向けにオンラインで発表されたもので、このC3標的治療薬がGA治療薬として初めてFDAに承認されてからわずか5ヵ月後に、アペリス社の株価は約半値に下落した。
2023年7月17日 eyewire newsより一部抜粋
ASRSとはAmerican Society of Retina Specialistsのことで、米国網膜専門医協会になります。
日本の眼科学会に近いものですね。
そこから、アステラス/IVERICの競合品であるSYFOVRE®に対する安全性の懸念を示す声明が出されています。
これを受けて、株価は半値近くまで下がったとのことです。
確かに確認したらガクンと下がってました。
いまやピーク時の4分の1ですね。
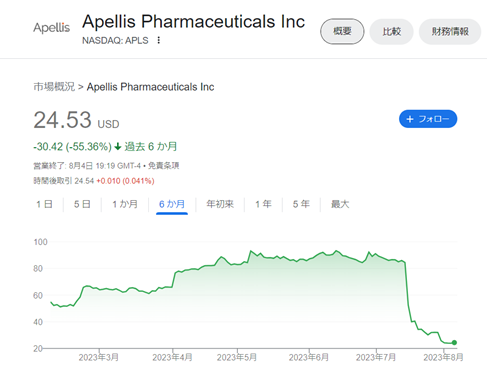
その後Apelisもプレスリリースで見解を発表しています。
Apellis Provides Update on Review of Rare Safety Events with SYFOVRE® (pegcetacoplan injection) for Geographic Atrophy
July 29, 2023
- No indication that drug product or manufacturing issues contributed to rare events of retinal vasculitis
- Confirmed seven total events of non-occlusive/occlusive retinal vasculitis since launch; more than 68,000 SYFOVRE vials distributed to date
- Zero events were reported in clinical trials, following more than 23,000 clinical trial injections to date
(日本語訳)
アペリス社、地図上萎縮治療薬SYFOVRE®(一般名:ペグセタコプラン注射液)のまれな安全性事象に関する最新情報を発表
2023年7月29日
・稀な網膜血管炎の発生に製品または製造上の問題が関与したとの示唆はなし
2023年7月29日 Apelis社プレスリリースより一部抜粋
・発売以来、非閉塞性/閉塞性網膜血管炎の事象を合計7件確認、これまでに68,000本以上のSYFOVREバイアルを配布
・臨床試験で報告された事象は0件、現在までに23,000回以上の臨床試験注射を実施
「まれな副作用なんだ」っということを強調したいようですね。
市販後の長期投与のデータを今後の学会で発表していくことも書かれていました。
今後の動向に注目ですね。
ただ、正直こういう安全性の懸念が出る薬はその後の信頼回復に相当苦労します。
これは正直痛すぎますね。
承認されたのは2023年2月17日。
まだ発売して半年もたっていないのに株価が4分の1にまで下がっているところを見ると、今回のASRSの声明はよほどのインパクトがある発表なのでしょう。
日本でいうブルーレター(緊急安全性速報)に近いインパクトがあると感じました。
競合品がこういう状況ですので、アステラス製薬・IVERIC社にはチャンスかと思います。
ただ、同じ轍を踏まないようにする必要があります。
強引にプロモーションしすぎると、不適切な患者さんへの使用に繋がり、結果として有害事象の発生が増えてしまうということにもなりますので、適正使用が何よりも大切です。
この薬剤に関するアステラス製薬の求人

以前のブログでも触れましたが、実はこの薬、日本では臨床試験が実施されていません。
ドラッグロスなんです。
でもですね、こういち予想では、今回のFDAの承認を受けて、日本での開発が決定されるのではと思います。
日本単独か、アジアも含めた国の臨床試験になるかはわかりませんが、おそらく試験は進むと思います。
すでにプロトコルや施設選定なんかも進んでいるのではと予想します。
なぜなら日本ではまだGAの治療薬は存在しないから。
ApelisのSYFOVRE®も日本では未発売です。
日本は高齢化社会です。
AMDの患者さんはたくさんいます。
そんな巨大市場があって、しかもアステラス製薬という研究開発型の企業なら、臨床開発しない手はないと思います。
完全に予想ですが、あながち間違ってないと思います。
(全然違ってたらすみません。アステラス製薬の開発の方に怒られてしまうかもしれませんね。)
こうなるとチャンスですね。
眼科に強いメーカーとしては参天、ノバルティス、バイエルなどが有名ですが、こういった会社の人はアステラス製薬で働くチャンスが出てくるというわけです。
アステラス製薬の案件は基本転職エージェントの大手であれば紹介可能かと思います。
私は以前エンワールドジャパンさんに案件を紹介してもらったことがあります。
ご興味ある方は頃合いを見て、ぜひ一度話を聞いてみてもらうといいかもしれません。
こういうのはタイミングが命ですので。
参考までにこういちが登録している転職エージェント一覧を掲載しておきますね。
エンワールドジャパン 製薬専門チームありです。 こういちおすすめ。

JAC Recruitment 外資系案件に強みをもっています。
マイナビエージェント どちらかというと内資系案件が多い。
リクルートダイレクトスカウト 本社系案件に強い印象。
【ランスタッド】 外資系案件に強みを持っています。
コンサルティング会社に興味があれば、登録しておいて損はないです。
特にBIG4(PwC/EY/KPMG/デロイト)とのコネクションが強く、実績を出しています。
20代なら挑戦するのもおおあり!キャリアの幅がぐんと広がります。
毎回ブログの中でお伝えしていますが、その時々で求人が入ってくるエージェントが異なる印象ですので、上位に上げたうちの1-2個は登録しておくことをお勧めします。
ということで本日の内容は以上になります。
アステラス製薬/IVERIC BIOの今後の動向に注目ですね。
アメリカでどれ位売れるのか、また注視していきたいと思います。
それでは本日の内容は以上です!
最後までお読み頂きありがとうございました!







コメント