この記事を読んでわかること ・イドルシアの現状とパイプライン
どうも、こんにちは。
外資系製薬会社経営企画室に勤めるこういちです。
ブログのアクセス数が順調に推移してまして、今月は6/10の段階で1万PV突破でした。
6月の目標は3万5千PVなので、なんとか頑張りたいなと思います。
嬉しいのは、Returning Visitorさんの割合が増加傾向なこと。
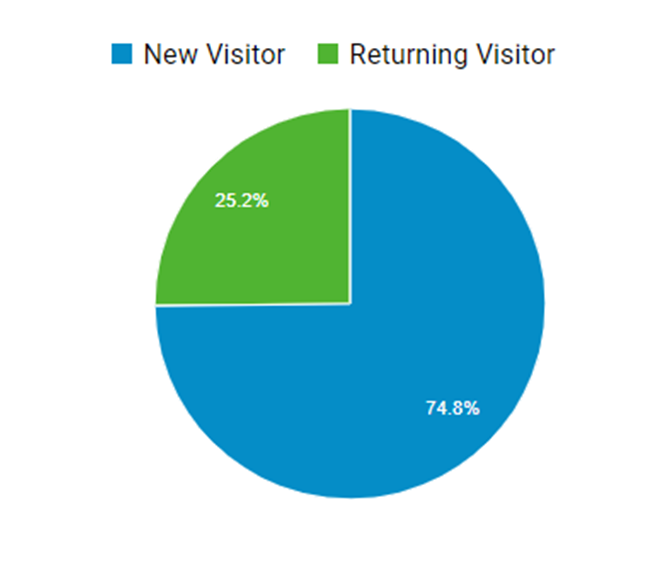
25%の方が再度ブログを訪れてくれているようです。
これは嬉しい。
ほんとありがとうございます。
モチベーションに繋がります。
これからも積み上げていきますので、よろしくお願い致します。
さて、今日は人気のある(?)外資系バイオベンチャーシリーズをお届けしたいと思います。
今日取り上げるのはイドルシアになります。

製薬界隈の方はすでにご存じですよね。
アクテリオンがJ&Jに買収される時に、スピンアウトという形で設立されたのがイドルシアという会社です。
法人設立が2017年。
初の海外法人が実は日本法人で、設立は2018年。
今年で6年目を迎える外資系バイオベンチャーです。
社長は、前日本法人のアクテリオンを率いていた田中諭さんが勤められています。
さて、基本情報はこれくらいにしておきます。
今日、私からお伝えするのは以下3点です。
①2022年の日本の売り上げ = 株主向け情報から抜粋
②2024年発売予定のファブリー病を対象にしたルセラスタットの情報
③2024年発売予定の不眠病を対象にしたダリドレキサントの情報
イドルシアに関心がある方向けに、知りたいだろうなという情報をピックアップしました。
ぶっちゃけイドルシアのGlobal ホームページにある株主向け情報は、文字が小さくて、よく見る売り上げのグラフとかがなく、情報が探しにくかったです。
USの売り上げは小さいので、あえてそういうのが分からないようにしたのかなと勘繰ってしまいました。
めずらしいですが、2022年の段階では日本が一番売り上げを上げていることもわかりました。
そのあたりの情報も2022年のFinancial Reportを見てみると情報が出てきましたので、簡単にではありますがご紹介したいと思います。
ではどうぞ。
ちなみに過去私は【ランスタッド】 から案件紹介を受けてます。
ご存じない方もいるかもしれないので、ランスタッドのことを書いた記事も添付しておきます。
2022年のイドルシアの日本の売り上げ
まず、イドルシアが日本で現在発売しているのは、ピヴラッツだけです。
イドルシア日本法人にとって初のお薬になります。
一般名はクラゾセンタンナトリウム
適応症は
「脳動脈瘤によるくも膜下出血術後の脳血管攣縮、及びこれに伴う脳梗塞及び脳虚血症状の発症抑制」
となっています。
承認が2022年1月、発売が2022年4月20日です。
その時のプレスリリースはこちら。
イドルシア発の製品であるピヴラッツ点滴静注液150mg (一般名:クラゾセンタンナトリウム) 日本で発売開始
https://www.idorsia.jp/documents/jp/press-releases/220420_Pivlaz-launch-JP_final_JP.pdf
2022年4月20日 イドルシア社 プレスリリース
顧客は脳神経外科がメインになります。
薬のことを詳しく知りたい方は、製品ホームページにアクセスください。
ピヴラッツ(脳血管攣縮発症抑制薬)開発の経緯|医療従事者向け情報サイト|イドルシアジャパン
私が知りたかったのは、この薬がどれくらい日本で売れているのかってことです。
中医協の資料によると、ピーク時(8年度目)予測販売額は138億円となってます。
さて、2022年、どれくらい売れているのか?
2022年のFinancial Reportにその情報がありました。
引用:P63 Idorsia Financial Report 2022
図が小さくてごめんなさい。
図にはUnited States(アメリカ)やRest of world(その他の国)と並行して、Japan(日本)と記載されています。
Product Salesの項を見ると、日本の売り上げが一番大きいことがわかります。
単位はCHF thousand (1000 スイスフラン=約150,000円)です。
JapanのProduct Salesの数字は43,977
つまり、43,977,000スイスフランが2022年の売り上げです。
1スイスフランが約150円です。
つまり、
43,977,000スイスフラン
≒
6,596,550,000円 (約66億円)
となります。
ピヴラッツの発売は2022年4月からなので、4-12月の8か月間で約66億円売り上げたことになります。
すごいですね。
この領域にあまり詳しくはないですが、ピーク時(8年度目)予測販売額は138億円だったことを考慮すると、かなり立ち上げに成功したと言えるのではないでしょうか?
一方で気になるのはアメリカのSalesです。
Utited StatsのProdct Salesは5,543
単位はCHF thousand (1000 スイスフラン=約150,000円)
なので、5,543,000スイスフランが2022年の売り上げです。
1スイスフランが約150円とすると
5,543,000スイスフラン
≒
831,450,000円 (約8.3億円)
あれ、小さくない??
なんで???
って正直思いました。
普通はUSのほうが売り上げ大きいのになんでだろう、、、
と思って、色々調べました。
それで理由がわかりました。
アメリカではピヴラッツ発売されてません!
この薬はPh3が日本の施設のみで臨床試験が行われたため、USでは発売になっていないようです。
そのあたりの背景は、2022年4月1日のプレスリリースに情報がありました。
2022 年 4 月 1 日 Idorsia Ltd (SIX:IDIA)とイドルシア ファーマシューティカルズ ジャパン株式会社は、本日 Journal of Neurosurgery 誌に「脳動脈瘤によるくも膜下出血後の脳血管攣縮に関連する症状及び原因を問わない死亡に対するクラゾセンタンの効果:日本人患者を対象とした 2 つの無作為化第 III 相試験」が発表されたことをお知らせします 。
クラゾセンタンは選択的エンドセリン A(ETA)受容体拮抗薬であり、aSAH 後の脳血管攣縮に関連する症状及び原因を問わない死亡の発現を有意に減少させ、安全性上予測できない事象も見られませんでした 。
脳動脈瘤によるくも膜下出血(aSAHはくも膜下腔に突然生じる生命を驚かす出血状態であり、動脈瘤の破裂によって引き起こされます 。
破裂を防ぐためには、緊急の治療として血管内コイル塞栓術または顕微鏡下クリッピング術が必要です 。
血栓の溶解そして血管収縮因子の放出は、脳血管攣縮を引き起こし、通常これは aSAH 後約 3 日後に始まり、8〜11 日目に重症度がピークに達し、21 日目までに消失する とされています 。
未治療の場合、脳血管攣縮は aSAH 患者の障害及び死亡につながる主要な要因となり得 ます 。脳血管攣縮により aSAH 患者において、最大 40%の遅発性虚血性神経脱落症状(DIND)に至り、 脳血管攣縮を発現した患者の半数は脳梗塞に至ります。
aSAH の発症率は 10 万人あたり年 22.5 人であり 、日本では世界の他の国々に比べ 2~3 倍高い発症率であり 、重大な問題となっています。
https://www.idorsia.jp/documents/jp/press-releases/220401_clazo-primary-manuscript-final_JP.pdf
aSAH 後の日本人成人患者における脳血管攣縮に関連する症状及び原因を問わない死亡の低減に対するクラゾセンタンの有効性及び安全性を評価する 2 つの前向き、多施設、二重盲検、無作為化、プラセボ対照 第 III 相試験が日本の 57 の脳神経外科において並行して実施されました。
2022年4月1日 イドルシア社プレスリリース
こんな情報を見つけました。
じゃあ、USやヨーロッパで発売しないのかな?
と思いましたが、その部分に関する補足の情報を同じプレスリリース内で見つけました。
備考
REACT について – クラゾセンタンのグローバル承認申請に向けた治験プログラム REACT は、aSAH 後の成人患者における脳血管攣縮に関連する遅延性脳虚血(DCI)による臨床的悪化の予防に対するクラゾセンタンの有効性及び安全性を検討する第 III 相試験です。
第 III 相試験は、脳血管攣縮 及び DCI のリスクが高い患者、至適用量、有効性を実証するための最良の指標、患者の安全性を確保する ために最適化された患者管理ガイドラインを特定するためのこれまでのクラゾセンタンの試験から得られ た知見に基づいています。
この試験は、顕微鏡下クリッピング術または血管内コイル塞栓術のいずれ かで治療された約 400 例の患者が 15 ヵ国の約 95 施設で登録され、試験の完了は 2022 年末を目標として います。
患者は、最長 14 日間にわたり、その地域の標準治療に加えて、クラゾセンタン(15mg / hr)またはプラセボのいずれかを予防的に静脈内持続投与するよう無作為に割り付けられています。
クラゾセンタンは、欧州(2003 年)及び米国(2006 年)において希少疾病用医薬品の指定を受けており、承認後それぞれ 10 年間及び 7 年間の独占期間を有しています。
https://www.idorsia.jp/documents/jp/press-releases/220401_clazo-primary-manuscript-final_JP.pdf
2022年4月1日 イドルシア社プレスリリース
あっ、やっぱり他の国での発売も計画されてるんだ。
そりゃそうですよね。
じゃあ進捗どうなんだろうと、Global試験であるREACT試験のことを調べにいったら、なんとPrimary Endopointが未達であったことが2023年2月に発表されていました。
あれま。
これは珍しいケースですね。
似たケースですと、日本では絶好調のミロガバリン(神経疼痛治療剤)がありますね。
USの発売が出来なかったのも、USでのPh3が未達だったことが原因であったと記憶しています。
それを思い出しました。
これはイドルシア社にとってかなり手痛いと想像します。
大きく計画が狂ったのではと予想します。
ということで、イドルシア社の現状としては日本が最も稼いでいる国になっています。
日本にとってはいいことですね。
投資もどんどんされるでしょうし、注目もされるでしょうから。
もしかするとそれが逆にプレッシャーになっているかもしれませんが。。。
内情はわかりません。
イドルシアの新薬、ルセラスタット: 対象はファブリー病

次はこちらの薬です。
日刊薬業の情報によると、すでに日本のPh3は終了しているようです。
色々調べていると、待ち望まれている薬のようです。
日本先天代謝異常学会からも以下の要望が出ていました。
2020 年 12 月:ファブリー病患者に対する基質合成抑制治療 薬ルセラスタット (イドルシア)の早期審査の要望書を学会より厚労省に提出した
令和 3 年度(2021 年)春 日本先天代謝異常学会理事会議事録
なるほど。
さて、日本の臨床試験情報を調べてみました。
ヒットしたのはこちら
【日本人ファブリー病患者を対象にlucerastat の長期投与時の安全性及び忍容性を検討する多施設共同、オープンラベル長期継続投与試験】
東京慈恵会医科大学付属病院
がIRBセンターです。
一日2回の経口薬のようです。
目標症例数は20例。
試験は継続中と掲載されてますが、令和4年12月14日時点の情報ですので、すでに終了している可能性もあります。
どれ位効果のある薬なのか、データがないかなと調べたところ、なんとこの薬、別途実施されたGlobal試験ではPrimary Endopoitが未達であったことが、2021年10月に発表になってました。
またも、、、、
悲しい。。。
その時のプレスリリスがこちら
Allschwil, Switzerland – October 11, 2021
“Idorsia Ltd (SIX: IDIA) today announced that MODIFY, the Phase 3 study to investigate the effect of lucerastat, as an oral substrate reduction therapy for the treatment of adult patients with Fabry disease, did not meet the primary endpoint.
Guy Braunstein, MD and Head of Global Clinical Development at Idorsia, commented:
“I’m very proud of everyone involved with MODIFY for delivering a very high-quality study, one of the largest in Fabry disease.Lucerastat was well tolerated and biochemically it did exactly what we were expecting; as previously seen, in this study we saw a substantial and consistent reduction of plasma Gb3, confirming the pharmacological activity of lucerastat.
Despite this biological effect, no reduction in neuropathic pain was observed after six months of treatment, using the patient reported outcome tool.”
Guy Braunstein, added:
“In MODIFY, many parameters have been collected and data are still being analyzed. In addition, most patients chose to continue in the open-label extension study and in a few weeks, we will see more results that will inform our decision on the future of lucerastat.”Jean-Paul Clozel, MD and Chief Executive Officer of Idorsia, commented:Idorsia announces the results of MODIFY, a Phase 3 study of lucerastat in Fabry disease 2021年10月11日 イドルシア社プレスリリース
“Taking into account the quality of the study, the volume of data we have collected, and some observations made in the six-month double-blind placebo-controlled treatment period, we need to wait for the results of the interim analysis of the open-label phase before making a decision. I expect to be in a position to share our future direction before the end of year.
かいつまんでご紹介すると、
・6か月間でプラズマGb3(おそらくファブリー病の原因酵素)の値は下がったことは確認できたけど、神経痛の軽減効果が6か月の治療で改善されなかった。
とのことです。
Open Label studyを継続して、さらなる解析を行うとのことですが、、、
未達ですか・・・
そうなると発売は中々厳しいものがありますね。
オープンラベルエクステンションの追加データ次第ではありますが、、、
ちなみにGlobal試験情報はこちら。
日本の施設は登録されておらず、日本は日本として治験をしているので、また結果は違うものになる可能性もあります。
日本の治験結果に期待ですね。
ピヴラッツみたいに、日本では治験が成功して、日本だけで発売が進むなんてことがあり得るかもしれません。
ということで、この薬に関しては日本のPh3結果の報告を待ちたいと思います。
申請は2023年上半期を予定していると、別の記事で見かけました。
結果がポジティブであれば、発売は早ければ2024年上半期になるのではと予想します。
イドルシアの新薬、ダリドレキサント: 対象は不眠症

さて次です。
この薬はGlobal開発に成功してて欲しい!!
という気持ちで見ています。
大丈夫です。
この薬はすでにアメリカやその他の国で発売されています。
アメリカが最速で2022年5月から発売になっています。
2022年11月にはイタリアやドイツでも発売になっています。
じゃあ、気になるのはどれくらい売れているかってことですよね。
そこで冒頭の図を改めて眺めてみます。
P63 Idorsia Financial Report 2022
Utited StatsのProdct Salesは5,543
単位はCHF thousand (1000 スイスフラン=約150,000円)
つまり、5,543,000スイスフランが2022年の売り上げです。
1スイスフランが約150円とすると
5,543,000スイスフラン
≒
831,450,000円 (約8.3億円)
です。
あれ?
あれれ?
小さくない?
不眠症の市場規模ってこんなもんだっけ?
というのが正直な感想です。
ということで、アメリカの不眠症の市場規模をささっとGoogleで調べました。
U.S. Insomnia Market – Global Forecast 2021 | MarketsandMarkets
このソースによると、 4.24 billion USD in 2021というのが確認できました。
2021年時点で、日本円で4500億円規模の市場があることがわかります。
ということで、USではまだまだ伸びしろがあるということですね。
8億円じゃ、ちょっと少ないですよね。
頑張って頂きたいです。
じゃあ日本はどうなのよ?ってところですが、Ph3の結果が良かったことが2022年10月3日にプレスリリースされていました、
ダリドレキサントの日本人を対象とした 第3相試験における良好な結果について
プレスリリースの中では2023年の上半期に厚労省に製造販売承認申請を行う予定であることが明記されていました。
このダリドレキサンについては、以下の先生のブログで詳しく解説が載っていましたので、ご興味ある方はご覧ください。
薬の詳しい説明は、上記ブログにお譲りするとして、一点だけ私が強調したい点は、コプロに関する情報です。
実はダリドレキサントについては、持田製薬さんとコプロすることが2019年12月の段階で契約済みです。
供給、共同開発、共同販売に関する独占的ライセンス契約です。
ということでこの薬は持田さんと一緒にプロモーションが展開されるということだけ触れておきたいと思います。
きっと今頃、どの科の先生たちはどっちがカバーするみたいな話し合いが行われていることを想像します。
申請が2023年の上半期ということで、発売は1年以上先になると思います。
にわか知識しかないですが、ベルソムラ(MSD)やデエビゴ(エーザイ)、また数多くある後発品が市場を取り合うバチバチのレッドオーシャン市場と思いますので、戦略立案と上市準備頑張ってください!
イドルシアに関心がある人は情報収集を!
さて、ここまでイドルシアの3つの薬について見てきました。
結論としては、
・Globalは微妙だけど、日本は好調!
というところかなと思います。
稼ぎ頭が日本という今の状況だと、日本への投資が進むことが予想されます。
人の採用も進むでしょう。
ちょうど1年前の2022年6月に、田中社長が日刊薬業のインタビューに答えていて、2022年5月の社員数は120人、年末には180人に増員したいとの情報がありました。
国内製品拡充へ、第2・3弾を年明けにも申請 イドルシア・田中社長「5年間で売上高800億円目指す」 | 日刊薬業 – 医薬品産業の総合情報サイト
2023年6月、果たしていまの社員数はどれ位になったのでしょうか。
ここは私も情報を持っていません。
興味ある方は、エージェントから情報収集しましょうね。
私は過去【ランスタッド】から案件を紹介されてます。
確か、ピブラッツのマーケティングのポジションだったと記憶してます。
さて、ここからはいつも書いてるオススメ転職エージェントのご紹介です。
過去のやりとりの情報も含めて書いていますので、ご興味ある方はお読み頂けたら嬉しいです。
エンワールドジャパン 製薬専門チームありです。こういち、いちおし。
JAC Recruitment 外資系案件に強みをもっています。
【ランスタッド】 外資系案件に強みを持っています。意外に知られてないですが、超優良です。
マイナビエージェント どちらかというと内資系案件が多い。
リクルートダイレクトスカウト 本社系案件に強い印象。
【アクシスコンサルティング】コンサルティング会社に興味があれば、登録しておいて損はないです。特にBIG4(PwC/EY/KPMG/デロイト)とのコネクションが強く、実績を出しています。20代なら挑戦するのもおおあり!キャリアの幅がぐんと広がります。
毎回ブログの中でお伝えしていますが、その時々で求人が入ってくるエージェントが異なる印象ですので、上位に上げたうちの1-2個は登録しておくことをお勧めします。
無料ですし、情報を得るには転職エージェントの方と繋がるのが一番です。
定期的に自分のスキルを棚卸して、転職エージェントさんと上手に付き合って、情報収集とキャリアアップを実現させていく。
今後の製薬でのキャリアを積み上げていく上で、必須のアクションだと私は考えています。
あとでやろう、またやろうと思ってると、どんどん時間が過ぎていきますので、アンテナ高く、キャリアを積み上げていきたい人はすぐ動いたほうがいいです。
いまの時代、すぐに動いた人、すぐに行動に移せる人が勝つ時代です。
本業でも副業でもなんでもそうです。
大転職時代は当たり前ですし、終身雇用なんてすでに過去のものになりつつあります。
ということで本日は以上です。
最後までお読み頂きありがとうございました!!
*追記 2023年6月16日 事業譲渡の可能性!?
Idorsia has entered into exclusive negotiations with regard to a prospective strategic transaction for its Asia Pacific (ex-China) operations for up to CHF 400 million
Ad hoc announcement pursuant to Art. 53 LR
Allschwil, Switzerland – June 06, 2023
Idorsia Ltd (SIX: IDIA) today announced that it has entered into exclusive negotiations with an undisclosed party regarding its operating businesses in the Asia Pacific (ex-China) region, including selected license rights to products from Idorsia’s portfolio in those territories, for a total consideration of up to CHF 400 million.
This prospective strategic transaction is subject to completion of satisfactory due diligence and legal documentation. Further announcements will be made as appropriate.
André C. Muller, Chief Financial Officer of Idorsia, added:
2023年6月6日 イドルシアグローバルプレスリリース https://www.idorsia.com/investors/news-and-events/media-release-details?newsId=3013739
“This prospective strategic transaction would allow Idorsia to realize the significant value we have created in the region, and would extend our cash runway, while maintaining relationships for the future development and commercialization of our pipeline programs in the region. I would expect the potential transaction to be completed during July, subject to completion of satisfactory due diligence and legal documentation.”
Twitter読者の方から教えて頂いた情報です。
Google翻訳すると、
イドルシア、アジア太平洋地域(中国を除く)の事業について、4億スイスフランを上限とする戦略的取引の見込みについて独占交渉に入る
スイス、オールシュヴィル – 2023年6月6日
イドルシア・リミテッド(SIX:IDIA)は本日、アジア太平洋(中国を除く)地域におけるイドルシアの製品群のライセンス権を含む事業について、総額4億スイスフランを上限とする独占交渉を非公開の相手と開始したことを発表しました。
この見込みのある戦略的取引は、十分なデューディリジェンスと法的文書が完了することを条件とします。詳細については、適宜お知らせします。
イドルシアの最高財務責任者であるアンドレ・C・ミュラーは次のように述べています:
「この戦略的取引により、イドルシアは、この地域で創出した重要な価値を実現し、キャッシュ・ランウェイを拡大するとともに、この地域における当社のパイプラインプログラムの将来の開発および商業化のための関係を維持することができるでしょう。この取引は、十分なデューディリジェンスと法的な文書作成が完了することを条件として、7月中に完了する見込みです。」”
2023年6月6日 イドルシアグローバルプレスリリース(日本語訳) https://www.idorsia.com/investors/news-and-events/media-release-details?newsId=3013739
ランウェイとは、ビジネスの分野において、「企業がキャッシュ不足に陥るまでの残存期間」のことを言います。
私はこの情報を見て、キャッシュ不足に陥るまでの残存期間を延ばすために、事業を売却する可能性があると読みました。
日本法人はイドルシアのキャッシュ不足を補うために、もしかすると、もしかすると、売却されてしまうかもしれませんね。
7月中には取引結果がわかるようです。
やはり開発品2剤の失敗が響いているんでしょうね。
日本法人の人からするとたまったもんじゃないですね。
Global開発の失敗を日本が補う形になるわけですから。
興味を持つとすると脳神経外科にパイプのある企業もしくはパイプを強化したいと考えている会社でしょう。
どこでしょうかね。
内資なのか、外資なのか。
4億スイスフランは日本円だと600億円位です。(1スイスフラン150円想定)
ピヴラッツの日本の売り上げが8か月で66億円と考えると、買い手側からするとかなりおいしい条件のようにも思えます。
今後も追加情報を注視していきたいと思います。
情報が入ったら、また公開します。
以上です。
情報くださったTwitteer読者の方2名にお礼申し上げます。
*2023年7月20日、そーせいによるイドルシアのアジア事業(中国を除く)買収が発表されました。
こういちの見解をまとめました。
*2024年2月追記
Answers さんも取り扱いがあることを確認しました。
製薬ニュースを毎日配信するAnswersNewsと連携しており、バイオベンチャーや大手製薬会社との提携をされていることも最近キャッチしました。
イドルシアとも繋がりがあるとは正直知りませんでした。
私がお伝えしたいのは、「どこどこのエージェントさんが一番良いですよ!」ということではなく、機会損失を防ぐために、複数の転職エージェントに登録したほうが絶対に良いという点です。
なぜならエージェントによって持っている案件や非公開求人が異なるためです。
その中でもAnswersさんは優良な転職エージェントさんになりえますよ!ということです。
ブログを読んで終わりとするか、5-10分ほど手を動かしてエージェントから情報を得ようとするかで、その後の人生の選択が変わってきます。
エージェントの登録をこれまでしたことがない、もしくはエージェントの登録を1社程度で済ませて満足されている方は、それだけで多くの機会損失が発生している可能性があります。
「望んでいたような求人が出ていたけど知らずに終わる」
これはもったいないですよね。
希望する求人と条件をテンプレートで良いので、エージェントさんに伝えておくと、それに近しいような案件が自然と入ってくるようになります。
そういうアクションを積み上げていくと良い案件と出会える可能性が増えていきます。
リストラ吹き荒れる製薬業界で生き抜くにはこういったアクションが不可欠だと私自身は考えています。
動く動かない、応募する応募しないは置いておいて、まずは選択肢を知る、Answersさんなどのエージェントに話を聞いてみるというところからアクションを起こしてはいかがでしょうか?
ということで追記は以上です。
最後までお読み頂きありがとうございました!








コメント