この記事を読んでわかること ・N-of-1のこと ・いまの日本の課題
どうも、こんにちは、外資系製薬会社経営企画室に勤めるこういちです。
今日は、以下のTwitterをきっかけに筆を執ることにしました。
78件のいいね、インプレッションは2万と多くの方に御覧頂いたツイートです。
元々は、以下のYahooの記事を見たのが始まりです。
難病の薬を開発できた…しかし、製薬会社の名乗りなく 患者は3人「救う道を」 神戸大研究グループが訴え
Yahooの記事を要約しますと・・・
- アルポート症候群(治療法のない腎臓の難病)の治療薬候補になる核酸医薬をマウスに投与。劇的な効果を確認。
- 使用したのは「核酸医薬」。個人の遺伝子を詳細に調べて病気の原因となる変異を突き止め、直接働きかけることが可能。
- 重症型のアルポート症候群の変異を軽症型に置き換える手法を開発した。
- 核酸医薬の合成法は確立しており、原因となる遺伝子が分かれば短期間で薬が完成できる。
- 人での臨床試験に進みたいものの、該当する患者は全国で3人しか見つからない。
- 商品化しても採算は見込めず、手を挙げる製薬会社は現れない。
- これまで国立研究開発法人日本医療研究開発機構(AMED)から得ていた研究開発費も打ち切り。
- 米国などでは核酸医薬開発を支援する仕組みがあり、たった一人のための薬も創られた。
- 長期間の高額な治療費をどう支えるかも含めて、日本に適したモデルの構築が求められる。
っとこのような内容になっています。
この記事の中で紹介されている
「たった一人のために核酸医薬開発を支援する仕組み」のことを米国ではN-of-1(エヌオブワン)
と呼んでいます。
今日はこのことをより多くの方に知ってもらいたいと思ってブログを書くことにしました。
なぜそう思ったのか?
実はこの仕組みのことは仕事を通じて、前々から知っていました。
でも今回のYahooの記事を読んで、改めて自分で調べていく中で、
「多くの方にいまの課題を知って貰って、関心を集めることが重要かもしれない」と感じ、こうしてブログに向かっています。
「救う手立てが見出せるかもしれないにも関わらず、日本では経済的な理由や仕組みが確立されておらず、迅速に臨床試験が行えない。一方で米国では仕組みが確立され、救える命がある。」
歯がゆいですよね。
製薬会社に勤める者として、とても悔しく思います。
ドラッグロスの問題もそうですが、住んでいる国によって受けられる治療が変わってしまう現状に悔しさを覚えます。
でもいますぐ私の力で会社を動かすことはできません。
収益が見込めない薬、むしろ赤字になる可能性が高い薬に対して、マネジメントに投資を要求することは中々のハードルがあります。
また行政を動かすことも難しい。
自分が出来ることは何かと考えた時に、ブログを通じて、何が問題か、米国ではどういう取り組みや現状があるかを伝えることなら出来ると思いました。
私のブログの訪問者は、製薬企業に勤める人やその周辺産業にお勤めの方、また医療従事者も多いと勝手ながら予想します。
ですので、私が情報を伝えることで、少しでもこの課題感に関心が集まり、何かの動きのきっかけになったら嬉しく思います。
そこまで行かなくても、みなさんの記憶に残って、
「どげんかせんといかん!(懐かしの東国原知事)」
と考える人が増えてくれたらいいなと思っています。
自分が調べた範囲の情報でしかなく、情報不足感がある部分についてはお許しください。
最後までお読み頂き、課題感を皆さんと共有できたら嬉しく思います。
N-of-1から生まれた薬「ミラセン」 in US

ここでは米国で生まれた核酸医薬「ミラセン」について情報共有します。
ミラセンについては、Googleで調べると、以下のようなURLが見つかります。
個別医療時代の幕開け、米国で1人の子どものための遺伝子療法が開発
核酸医薬だから実現できた「患者の受診から診断、設計、投与まで1年」:日経バイオテクONLINE
致死的な脳の病気を持つ女の子のために作られたカスタムメイドの遺伝子治療
ご興味ある方はクリックしてお読み頂けると嬉しいです。
簡単にこれらの記事から内容を抜粋すると、
- 世界で一人、あるいはごく少数しか患者がいない超希少疾患に治療薬を届ける「N-of-1(エヌオブワン)医療」と呼ぶ取り組みが欧米で広がっています。
- きっかけはアメリカボストンに住んでいたミラちゃんという、一人の6歳の女の子。
- 2017年当時、ミラちゃんはバッテン病と呼ばれる稀な脳の病気を持っていました。
- バッテン病はてんかん発作を引き起こし、視力、運動能力、認識力を奪い、最終的には10代か20代で死に至る恐ろしい遺伝性の病気です。
- 立ち上がったのはボストン子供病院の神経内科のユー先生(Dr. Timothy Yu)
- ユー先生のチームはミラちゃんのためにカスタムメイドの遺伝子治療薬(=核酸医薬)を開発しました。
- 作られた治療薬の名前は「ミラセン」
- ミラセンは遺伝子治療である核酸医薬の1つで、正常なCLN7を補充することでミラちゃんのバッテン病を治療することができます。
- ミラセンによる治療は2018年初頭に開始され、2019年10月9日付のニューイングランド・ジャーナル・オブ・メディシン誌(世界的な医学雑誌)にその治療効果が報告されました。
- ミラちゃんは残念ながらその後2021年に亡くなりましたが、ミラセンで発作を抑えることには成功したとのことです。
- 通常、新薬は基礎研究が始まってから人に投与する治験までに3~5年かかります。ミラセンのケースは研究者と米国食品医薬品局(FDA)が協議し、治験前の一部の試験を簡略化、10カ月で治験に進むことができました。
- この事例によりN-of-1医療が活気づきます。核酸医薬を開発する米国の製薬会社、アイオニスの創業者は私財を投じてファンドを創設。
- 患者の遺伝子診断から核酸医薬の創製、治験対応と治療を支援するスキームを構築し、研究開発はアイオニスが、製造では受託大手の日東電工が協力している。欧州でも同様の枠組みを検討中。
以上、色々な記事の記載をお借りして、核酸医薬「ミラセン」に関する情報を共有しました。
この「ミラセン」を作るにあたっては、母親が「Mila’s miracle foundation」を立ち上げ、寄付を募り、300万ドル(1$100円とすると、3億円)を集めたという情報があります。
その後、この仕組みを持続可能なものにするために、アイオニスの創業者は私財を投じてファンドを創設したという流れがあるようです。
私がこれらの記事を読んで感じたことは、「さすがアメリカのスピード感」という感想です。
コロナのワクチン開発や治療薬開発についてもそうですが、動きが早い。
「患者さんを救うんだったら、規制とか仕組みとか見直せばいいよね。お金もないなら集めよう!みんな協力していこうよ!」
みたいな感じで物事が動いていく。
多少強引だったり、雑な部分もあるにはあるんでしょうけど、こういう部分は日本の行政は見習うべき部分が多いと思います。
日本の動き

では日本のいまの動きはどうなっているのでしょうか?
懸命に動いている先生たち、学会、報道がありますので、その情報を中心にお伝えしていきます。
まず、この「N-of-1」の仕組みを「どげんかせんといかん」と動いているのは、東京医科歯科大学の横田教授です。
核酸医薬学会の会長でもある横田先生は、患者さんを救うために様々な場所で精力的に講演を行っておられます。
関連する記事はこちら
「N-of-1医療」、新たな規制枠組み求める声も 核酸医薬学会シンポ、米国事例を基に議論 | 日刊薬業 – 医薬品産業の総合情報サイト
また学会の要約はこちらから確認することができます。
ぜひみなさんの目に触れてほしいので、あえて学会の要約を原文ママに引用させて頂きます。
米国で先行する超希少疾病の核酸医薬を用いた個別化医療 (N–of–1)
東京医科歯科大学大学院医歯学総合研究科脳神経病態学分野 横田 隆徳
希少疾患は個々の疾患患者数は少ないものの,対象疾患数は約7,000疾患と非常に多く,希少疾患全体で考えると日本で約600万人の患者が推定されている.
希少疾患は,近年の次世代シークエンサー技術の進歩により個別症例であっても遺伝学的診断に至る例が増加してきた.
最近,希少疾患の患者に対して核酸医薬に治療が可能な医薬の上市が続いている.
遺伝性の超希少疾患に対する「N–of–1+創薬」においては,患者の少なさで治験の構成はできず,数名の患者で仮に治験ができたとしても,経済的に製薬会社が行うのは困難である.
2018年,この究極の個別化医療が現実に可能であることが実証された.
ハーバード医科大学ボストン小児病院のTimothy Yu博士らは,乳児発症の神経セロイドリポフスチン病(Batten病)という神経希少疾患に罹患した7歳の女児に,アンチセンスオリゴを用いた個別化臨床治験を行った.
核酸医薬が最も適切な創薬モダリティーの1つと考えられる.
核酸医薬は,特定の遺伝子配列を目的として特定の配列を設計し合成することが可能で,分子遺伝学的に診断がつけば異常部位に対して様々なアプローチを検討することが可能である.
アンチセンス核酸医薬(Antisense Oligonucleotide:ASO)を例に挙げれば,スプライシングを制御するための配列設計などが可能であり,異常タンパク質の発現を抑制や,欠乏したタンパク質を回復させるなど目的に応じていくつかの戦略をとることができる.
さらに,Ionis社の創設者であるStanley Crooke博士が2020年n–Loremという非営利団体を設立しすでに10人以上のの超希少疾患の患者に対してオーダーメイドのASOを開発して治療を推進している.
2019年米国食品医薬品局(FDA)に特別検討委員会が設立され,ASOを用いた個別化医療の再現性の確保と同時に開発プロセスの効率化を図るための指針が検討された.
N–of–1+創薬は既存の商業モデルでは対応できないことは明らかであり,N–of–1+は各国の医療制度や国民性などそれぞれのあった枠組み(モデル)が必要である.
すでに診断がついて治療可能な希少疾患患者が多数いて核酸医薬治療を待っている現状を踏まえ,日本の環境に適応した「日本版N–of–1+創薬」が少しでも実現することを期待したい.
核酸医薬学会 2022年 特別プログラム抄録 https://www.jstage.jst.go.jp/article/jsnt/39/6/39_S177/_pdf
勉強になる内容ですよね。
またこれとは別に、Bio Japan 2022 でも横田先生はご講演されています。
日経バイオテクの副編集長である久保田さんと共に、講演されています。
Bio Japan 2022年の講演会の様子は2022年10月27日にYou Tubeにて公開されていますので、リンク共有しますね。(まだ閲覧数が少ないので、拡散希望です。)
BioJapan2022 N-of-1(1)久保田 文氏、横田 隆徳氏
BioJapan2022 N-of-1(2)Prof. Philip Beales
BioJapan2022 N-of-1(3)パネルディスカッション
以下いくつか写真です。

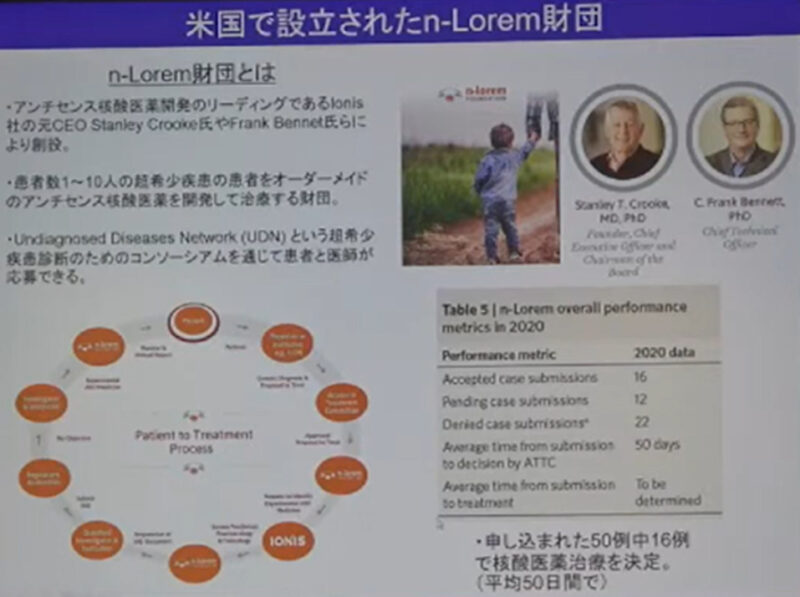

数枚ですが、プレゼン資料の一部もコピペさせてもらいました。
You Tubeについては、ご興味ある方は御覧頂きたいと思います。
非常に詳しく講演されておりますので、多くの方の目に触れてほしいと思います。
日本の課題


正直に申し上げると、私自身もすべての枠組みや仕組みを理解しているわけではありません。
①安全性・品質評価(レギュレーションや枠組み)の問題
②高額なコスト負担者の問題
があるということは理解できました。
しかし、①は具体的に何が問題になるのか、最初理解し兼ねました。
そこで”N-of-1, 課題”とGoogleで検索したところ、冒頭でご紹介した核酸医薬のシンポジウムで、武田薬品にお勤めで現在 TーCiRAディスカバリーアンドイノベーションにご所属の梶井靖さんの抄録を発見しました。
勉強になる内容ですので、以下に共有したいと思います。
産業界から見たN–of–One医薬品創出へ向けた課題
武田薬品工業(株)T–CiRAディスカバリーアンドイノベーション 梶井 靖
医薬品の製品化プロセスは,まず,病態を再現した何らかの非臨床モデルを構築し,そこで治療薬候補分子の有効性を評価することから始まる.
次いで,有効性が示された候補分子の安全性を非臨床試験にて検討し,ヒトに投与した際の安全性が十分に予測できると判断された場合,安全性の確認を目的とした比較的小規模の臨床試験を実施した上で,対象疾患に対する有効性と安全性のバランスを科学的に検証する臨床試験を統計的に妥当な規模まで拡大して実施し,その結果に基づき,治療薬としての妥当性が各国の規制当局によって判断される.
こうした慎重なプロセスによって承認された治療薬であってもなお,限定的な条件下で実施される臨床試験では予見できない事象が実臨床で発生するリスクがあり,医薬品製造販売責任を担う製薬企業は品質を担保した医薬品の安定的な供給を行いながら市販後のモニタリングと最新情報に基づく適正使用を推進する義務を負っている.
N–of–One治療薬の場合,上記の過程で承認された核酸医薬品等の標的配列の一部変更によって少数であっても対象患者が医療上の利益を得られることを期待できる状況が想定されているが,該当する臨床試験規模が大幅に制限される条件下において,配列および対象疾患の違いが有効性と安全性のバランスにどのような影響を与えるかを高い精度で予測することは容易ではない.
また,少量多品種の品質管理は通常の大量単品種におけるそれとは必ずしも同等ではなく,単純な製造ライン転用は困難と予測される.
このように,単に経済収支上の問題だけではなく,N–of–One治療薬の品質と共に有効性と安全性のバランスを担保し,治療対象者の利益をどのように確保するかという枠組み自体が重要であり,その枠組みに対して規制当局や医療機関と共に産業界がどのような役割を担うかという点を明確化し,広く社会的な合意を形成することが求められる.
即ち,資金や技術的課題の解決以前に,誰がどのような役割と責任を担うかという基本フレームの設計が重要と考えられる.
核酸医薬学会 2022年 希少疾病の核酸医薬による超個別化医療(N of 1治療)の展開–5 https://www.jstage.jst.go.jp/article/jsnt/39/6/39_S181/_pdf
いかがでしょうか?
なかなか難しい課題感ではありますが、私の理解では日本ではN-of-1を実現するためには、まず枠組み(誰がどのような役割と責任を担うかという基本フレームの設計)が必要と理解しました。
米国ではFDAがN-of-1を実現するためにガイダンス(ガイドライン)を2021年に出しております。

また緊急個別IND(治験届)初回申請の取り決めや治験開始後の安全性報告や追加データ提出など、細かな取り決めがすでにあるような状況です。
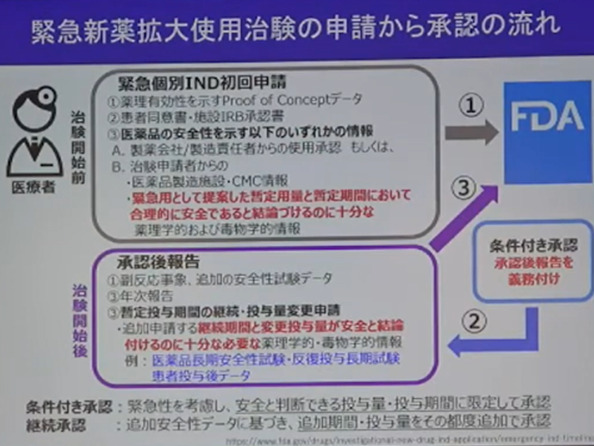
梶井さんがおっしゃっているのは、おそらくこういった一連の流れの事で、日本の実状に合わせた枠組み(誰がどのような役割と責任を担うかという基本フレームの設計)が必要になると訴えていると理解しました。
ではこの枠組みを作るのは誰か?
これは行政、すなわちPMDAしかありません。
講演の中ではPMDAの方とも協議を進めているといったお言葉も聞かれますので、現在進行形で話が進んでいると予想します。
しかし、コロナの時もそうですが、日本のPMDAの判断には時間が掛かるのが一般的です。
この判断を早くするために必要になるのが、患者さんの声や世論になります。
ぜひ多くの方に関心を持ってもらいたいなと思います。
ただ行政も何もしていないわけではありません。
AMEDのほうでは「ゲノム情報に基づくN-of-1+創薬研究」の公募が令和5年2月-3月に掛けて出ておりました。(もうすでに〆切は終了。詳しくは以下。)
令和5年度 「難治性疾患実用化研究事業(希少難治性疾患の個別化医療の推進等に資する研究分野)」に係る公募について
なので支援はしているという状況です。
(まあ重箱の隅をつつかせてもらうと、公募要項は非常に分かりにくいですし、N-of-1 + 創薬が目立つ形で明記されているわけではありません。
このあたりはまだまだ関心が集まっていないからなのかなと勘ぐってしまいました。)
っとここまでが調べた情報になります。
いかがでしたでしょうか?
長い文章で読み疲れた方もいらっしゃると思いますが、何かしらお感じ頂いた部分があったのではないでしょうか?
私はYou tubeを拝見し、また自分で調べる中で、何か少しでも力になりたいと思いました。
なので超微力だということは分かっているのですが、こうして筆を執った次第です。
一日でも早く、日本版N-of-1の仕組みが整備されて、この国の難病の患者さんに薬が届く未来が築かれることを切に願います。
ということで本日は以上です。
長い文章にも関わらず最後までお読み頂きありがとうございました!!



コメント