この記事を読んでわかること ・Amylyxの開発パイプライン ・Amylyxの2024年1月11日時点の日本の求人情報
*当サイトではアフィリエイトプログラムを利用しています。
どうも、こんにちは。
外資系製薬会社経営企画室に勤めるこういちです。
私も大好きなこのシリーズを今日はお届けします。
注目の外資系バイオベンチャーシリーズです。
THE バイオベンチャー的な会社が日本で立ち上がりました。
ニュースで知ったという方も多いのではないでしょうか?
扱うことになる薬はALS患者さんの福音になることができる有望な薬剤です。
個人的にも、気になる会社ですし、この会社が扱うことになる薬は社会的にも非常に意義のある薬剤です。
今日はそのあたりの情報に関して、深堀を進めていきたいと思います。
Amylyxとは
まずはAIで調べた情報を網羅的に記載していきます。
Amylyxは、米国マサチューセッツ州ケンブリッジに本社を置く製薬企業です。
神経変性疾患の治療薬の研究開発に取り組んでおり、2013年にブラウン大学の学部生だったジョシュア・コーエンとジャスティン・クリーによって設立されました。
Amylyx Pharmaceuticals, Inc.(AMLX)は、2022年1月7日にNASDAQに上場しました。
Amylyxが開発した薬剤:AMX0035
AMX0035は、フェニル酪酸ナトリウムとタウルウルソジオール(米国以外ではウルソドキシルタウリンとも呼ばれる)の経口配合剤です。
AMX0035は、致死的な神経変性疾患である筋萎縮性側索硬化症(ALS)の治療薬として開発されています。
臨床試験では、ALSの進行を25%以上遅らせ、生存期間を6カ月以上延長する効果が確認されています。
AMX0035は、カナダで「アルブリオーザ」という商品名で条件付き承認(2022年7月)されており、米国では「RELYVRIO」という商品名でFDAの承認(2022年9月)を受けています。
この薬は、臨床試験でALS患者への安全性と有効性が確認されており、第II相試験のデータでは「ALSの進行を25%以上遅らせ、生存期間を6カ月以上延長する」という主要評価項目を満たしています。
AIによる検索
やはり、AI便利ですね。
概略を掴みに行くだけであれば、すぐに色々なことが調べられる時代になりました。
さて、もう少し深堀をしていきたいと思います。
そういうときは、本家本元のGlobalサイトに情報があることが多いです。
サイトを探しにいったらやはりありました。
Amylyx Pharmaceuticals Corporate Presentation January 2024
Corporate Presentationの資料です。
2024年1月のものなので、現時点(2024年1月11日)では最新の情報です。
全部で39枚のプレゼンテーション資料です。
すべて紹介しきれませんので、いくつかの部分を抜粋して、ご紹介していきたいと思います。
株主向け資料:Amylyxの現在地

まずハイライトページから。
『2022年9月にアメリカで承認されたAMX0035は、2023年9月30日時点、つまり約1年間で3900人の人に届けられた』
とありますね。
そして
『米国での最初の3四半期における発売で$272.3Mのrevenueを生み出した』
と記載されてます。
いま1ドル145円で計算すると、
約394億円になります。
結構な勢いで処方されていることが読み解けます。
どういったペースで処方されているかは、P7に推移がありました。
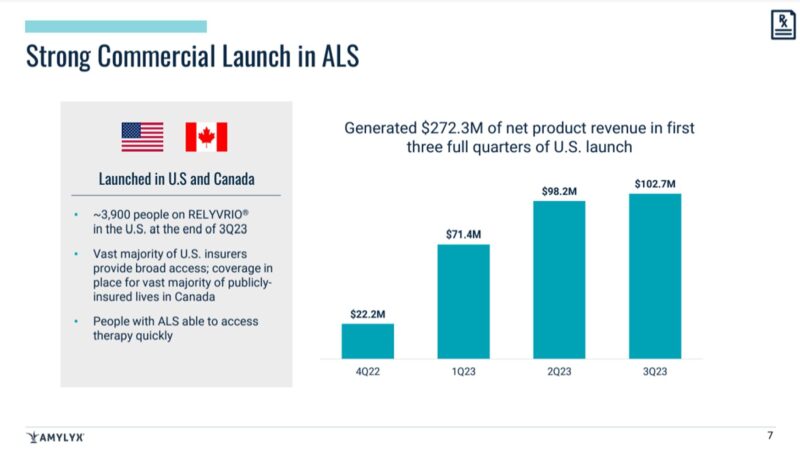
23年の2Qから3Qに掛けて、伸びは鈍化している風に見えますが、4半期毎になるので、そう見えるのかなと思います。
年単位で見ていけば、23年に処方が急増していることが読み解けますね。
P8-P11には承認申請で使われたPhase 2 試験であるCENTAUR 試験の結果が掲載されています。
その中の一つだけ抜粋します。
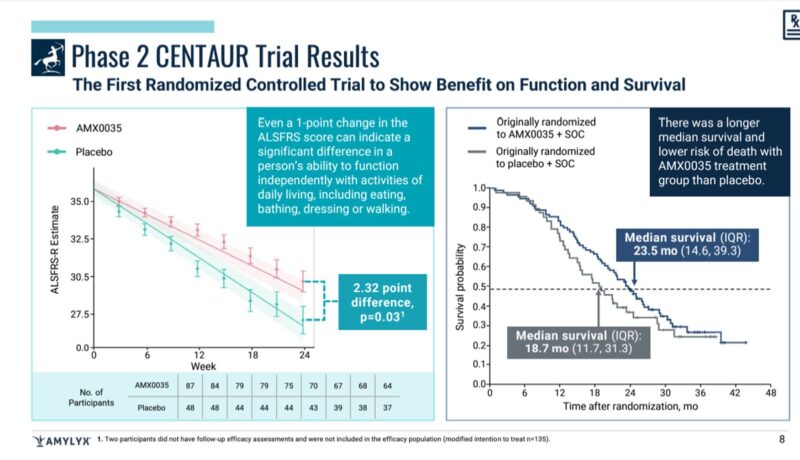
左の図の評価項目はALSFRS-Rスコア*です。
ALSFRS-R*(筋萎縮性側索硬化症機能評価スケール改訂版)は、ALS(筋萎縮性側索硬化症)患者の日常生活を把握するための評価尺度です。
言語、嚥下、身の回りの動作、歩行などの12項目(0~4の5段階)で構成され、その合計点(0~48)で評価します。
ALSFRS-Rスコアは、ALSにおける生存期間を予測する指標として用いられます。また、経時的に計測することで、患者の病態進行の程度の把握や予後予測にも用いることができます。
ALSの症状が進行するとALSFRS-Rのスコアが低下します。1ヶ月間のALSFRS-Rのスコアが0.67以上低下している例では進行が急速であることが報告されています。
AIによる検索
「食事、入浴、着替え、歩行などの日常生活動作は、ALSFRSのスコアが1点変化するだけでも、その人の能力に大きな差が生じる。」
と記載されています。
それが、プラセボと有意差がついており、その数値が2.32ポイントの差であったことが図示されています。
もちろん、統計的に有意な差が確認されています。
右の図は生存期間の中央値を見たグラフです。
『AMX0035治療群はプラセボ群より生存期間中央値が長く、死亡リスクが低かった。』
と記載があります。
プラセボ18.7か月であるのに対し、AMX0035治療群は23.5か月であったことが読み解けます。
これがP8の要約です。
P9~P11にはそれ以外の解析結果や安全性の結果が掲載されています。
興味がある方は、元資料を見にいってみてください。
個人的に興味深かったのはP12でした。

この薬、どうやら味に難点があるようで、いま、味を改善するための新しい剤型の開発を進めているという記載を見つけました。
図の中では、味が服薬意欲にそこまで影響を与えないことがReal World Dateという形で示されています。
ただ、会社としては改善を望む声が多く入ってきているので、新しい剤型の開発に取り組んでいるのではと予想します。
(これは完全な想像ですが、新しい剤型のPhase1試験を2024年に始める予定と書いてあるので、あながち間違いではないかなと思います。)
P15-P18には、Phase3試験であるPHOENIX studyのことがまとめられています。
カナダに関しては、Phase2データによる条件付き承認ということで、このPhase3のデータで持って、本承認となるようです。
P16の図だけ抜粋します。

CENTAURから学んだことをPHOENIXに応用
- ALSのトップリーダーとCENTAURとPHOENIXをデザインした
- PHOENIXとCENTAURの集団はベースラインの特徴が似ている
- PHOENIXでは664人が登録され、CENTAURでは137人が登録された
- PHOENIXの主要評価項目であるALSFRS-Rの進行度はCENTAURと同じである。
上記のような記載を見つけることができました。
規模を大きくした試験ですね。
この試験のTopline Resultは2024年Q2であることがP17に掲載されています。
結果が発表になったらまたフォローしていきたいと思います。
株主向け資料:Amylyxのパイプライン
P4にパイプライン情報がまとまっています。

基本的には薬剤はAMX0035のみになります。
他にAMX0114、Bax and Bak protein inhibitorsも記載がありますが、まだ前臨床の段階のため、期待するのは時期尚早だと思います。
従って、今後5-10年はAMX0035の地域拡大と適応拡大がメインになってきます。
その関係で日本法人も立ち上がったのでしょう。
さて、適応拡大で上がっている疾患としては3つあります。
・PSP:Progressive Supranuclear Palsy (進行性核上性麻痺)
・WS:Wolfam Syndorom (ウォルフラム症候群)
・AD:Alzhemier’s Disease (アルツハイマー型認知症)
PSPとWSはなじみがなかったので、調べたところ、どちらも神経に異常をきたす病で、日本でも国が指定する、指定難病でした。
難病情報センター
この進行性核上性麻痺はphase3が予定されているとのことです。
P30に日本も候補に入っているという記載を見つけました。
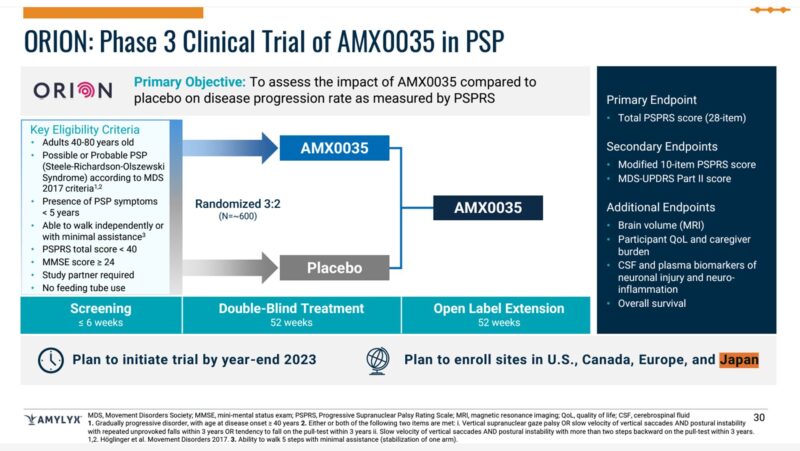
オリオンスタディというようです。
名前がかっこいいなと思いました。
2023年の終わりには試験を開始予定と書いてあります。
日本の治験情報は現時点では見つけることが出来ませんでしたが、
日本の治験施設のエントリーも今後進んでいくものと思われます。
後述しますが、ALSを対象にしたAMX0035の試験に、日本は入っていませんでした。
PSPに関しては最初から日本もエントリーが予定されているのは喜ばしいことですね。
Amylyx日本法人
さて、ここから日本の状況を見ていきます。
まず日本法人自体は2023年9月に立ち上がっています。
そして、11月に正式にプレスリリースが出されました。
PR TIMESさんの記載をそのまま引用します。
ALS等神経変性疾患の治療薬の研究開発に取り組むAmylyx、日本法人設立
アミリックス・ファーマシューティカルズ・ジャパン株式会社
2023年11月27日 11時00分
神経変性疾患に対する新規治療薬の研究開発に取り組む製薬企業Amylyx Pharmaceuticals, Inc(以下、Amylyx)は、この度、日本法人としてアミリックス・ファーマシューティカルズ・ジャパン株式会社を設立しましたので、お知らせします。
Amylyxは米国マサチューセッツ州ケンブリッジに本社を置き、グローバルに事業を展開しています。神経変性疾患において神経細胞死を引き起こす原因を解明するため、2013年に当時ブラウン大学の学部生であったジョシュア・コーエンとジャスティン・クリーが共同経営責任者となり創業しました。
Amylyxは、 第一線の医師、筋萎縮性側索硬化症(ALS)を抱える人々、支援団体のリーダーを含むALSコミュニティと緊密に連携をとりながら、10年以上にわたりALSの治療薬の開発に取り組んできました。2022年には、Amylyx独自のフェニル酪酸ナトリウムおよびタウルウルソジオールの経口の配合剤であるAMX0035が米国で成人のALS治療薬として承認され、カナダにおいてもALS治療薬として条件付きで承認されました。
本剤は、ALS患者を対象とした試験において、初めて身体機能と生存期間の両方で有効性を示した唯一の治療薬です。
Amylyxの日本法人であるアミリックス・ファーマシューティカルズ・ジャパン株式会社は、2023年9月に設立されました。代表取締役 日本事業統括責任者は、これまでに日本ベーリンガーインゲルハイム株式会社、アストラゼネカ株式会社、Alnylam Japan株式会社など複数の製薬企業に従事し、疾患を抱える人々に革新的な治療選択肢をお届けするために事業をリードしてきた実績のある小脇浩史が務めます。
この度の日本法人設立に際し、小脇は次のように述べています。
「Amylyxの使命は、神経変性疾患による苦しみをこの世界からなくすことです。神経変性疾患を抱える人々やご家族が、より良い日々、より良い時間を過ごせるように、治療薬の開発に注力しています。
ALSは絶え間なく進行する疾患であり、世界における患者数は少なくとも20万人と推計されています。
Amylyxの第一号製品であるALS治療薬のカナダおよび米国での承認取得後、日本国内の早期開発等に関する要望書や、早期承認を求める10,750人の署名が、患者団体より厚生労働省に提出されています。
私たちは、皆さんの『一刻も早く』という思いにお応えできるよう、早期に治療薬をお届けすることを目指しています。
日本法人設立はこの第一歩であり、引き続き関係機関との協力のもと、国内の医療のさらなる充実に向けて尽力してまいります」
当社は、AmylyxのALS治療薬をはじめとする神経変性疾患治療薬が日本国内においても承認され、治療選択肢を求める人々にいち早く提供できるよう、事業体制構築を迅速に進めてまいります。
ALSについて
筋萎縮性側索硬化症(Amyotrophic Lateral Sclerosis: ALS)は、脳と脊髄の運動ニューロンの変性・喪失によって引き起こされる進行性の神経変性疾患です。ALSでは、運動ニューロンの変性・喪失により、筋肉の機能が低下し、移動や会話が困難となり、呼吸不全が生じます。
ALS患者の90%以上は孤発性であり、明確な家族歴はみられません。
ALSの患者数は、日本では約10,000人、米国では約29,000人、欧州連合および英国では30,000人以上と推定されています。
ALSの診断からの生存期間の中央値は約2年とされています。
ALSは、日本では指定難病に位置づけられています。
AMX0035について
AMX0035は、フェニル酪酸ナトリウムおよびタウルウルソジオール(米国以外ではウルソドキシルタウリンと呼称される場合があります)の経口の配合剤です。本剤は、米国では成人の筋萎縮性側索硬化症(ALS)の治療薬として承認されており、カナダではALSの治療薬として条件付きで承認されています。
本剤は、ALSおよびその他の神経変性疾患の治療の可能性について、複数の地域で治験薬として研究が進められています。
本剤は、日本ではいずれの適応についても承認されていません。
Amylyx Pharmaceuticals, Incについて
Amylyx Pharmaceuticals, Incは、革新的な治療法の発見と開発を通じて、神経変性疾患コミュニティをサポートし、人々の大切な「時」を生み出すことに取り組んでいます。Amylyxは米国マサチューセッツ州ケンブリッジに本社を置き、カナダ、EMEA、日本で事業を展開しています。
詳細はhttps://www.amylyx.com/をご覧ください。
この他の公式オウンドメディア:
LinkedIn https://www.linkedin.com/company/amylyx /
Twitter(X) https://twitter.com/amylyxpharma /
投資家向け https://investors.amylyx.com/
Amylyx Pharmaceuticals, Inc本社
121 First St
Cambridge, MA 02141 USA
設立
2013年2月
従業員数
約350名
Co-CEO & Co-Founder(共同経営責任者 兼 共同創業者)
Joshua Cohen(ジョシュア・コーエン)
Justin Klee(ジャスティン・クリー)
アミリックス・ファーマシューティカルズ・ジャパン株式会社本社
東京都千代田区大手町1-5-1
大手町ファーストスクエア イーストタワー4F
設立
2023年9月
主な事業内容
医薬品の製造および販売
代表取締役 日本事業統括責任者
小脇 浩史(こわき ひろし)
2023年11月27日 PRTIMES
ちなみにほぼ同じ内容が、Global サイトでも確認できますので、ご興味ある方はどうぞ。

私がこの記載を見て、特に驚いたのが、日本において、すでに1万人を超える方から、この薬の早期承認を求める署名が集まっていることでした。
日本で治験が実施されていないにも関わらず、です。
これだけ患者さんから熱望されている薬剤はないのではないかと思います。
それだけ、この病で苦しんでいる方が多くいらっしゃる状況ということですね。
そして色々調べていると、2023年1月に、すでに患者会から未承認薬・適応外薬の要望が厚生労働省に提出されていることもわかりました。
以下がそのPDFのリンクです。
一般社団法人である日本ALS協会が取りまとめた要望書になります。
https://www.mhlw.go.jp/content/11120000/IV180.pdf
この時は、まだ日本法人設立前でした。
そこで臨床試験の要望が出ていました。
”実施すべき試験の種類とその方法案 ”
1)厚生労働省、PMDA、日本神経学会の推奨する、オーファンドラッグとしての迅速審査・製造承認につながる試験。
2) 現在進行中のThe Phase 3 PHOENIX clinical trial (NCT05021536)に準じた国内ALS患者対象の試験。
日本ALS協会要望書
こういった強い要望も相まって、日本法人設立という方向性に米国本社も舵を切ったのではないかと思われます。
明確なドラッグロスの状況だと思いますので、ここはなんとかしたいですね。
その状況を変えるために、日本法人を立ち上げたのがAmylyxです。
その決断と、それをリードされる小脇社長のことは個人的にものすごく応援しております。
今後日本でも治験が立ち上がり、承認に向けての活動がスタートしていくと思います。
ぜひ、患者さんのために頑張って頂きたいです!
Amylyxの日本の求人情報
いまは絶賛、三役を募集してますね。
Linkedinでも確認ができます。
製薬会社における三役とは、総括製造販売責任者、品質保証責任者、安全管理責任者のことです。
医薬品等の品質管理や安全管理を適正に行うために、製造販売業者にはこの三役の設置が義務付けられています。
またGlobalサイトでも求人が確認でき、現時点で人事のTopとFinanceのTopの求人が出ております。
情報は日々更新されていくと思いますので、興味ある方はサイトを覗いてみてください。
この会社の求人情報を有している可能性のあるエージェント情報を以下に記載します。
JAC Recruitmentさんは、こういった立ち上げ支援も多く実施されている会社です。
また【ランスタッド】も元々はヨーロッパ系の人材紹介会社で立ち上げ実績豊富です。案件有している可能性あります。
またAnsewersさんも積極的にこの手の会社さんをサポートしていることも最近わかりました。
興味ある方はぜひ、情報取ってみてください。
ということで本日は以上になります。
個人的には、激熱な会社が日本に上陸したと思っています。
売り上げ規模とか、この会社が今後ビックファーマになっていくとかそういうことではなく、ALSの患者さんは、本当に薬の登場を待ち望んでいるからです。
日本での治験が成功し、この薬が日本社会で使えるようになることを切に願っています。
ものすごく応援しております!
ということで、本日の内容は以上になります。
最後までお読み頂きありがとうございました!






コメント