この記事を読んでわかること ・BeiGene(ベイジーン)の魅力ついて
*このページにはアフィリエイト広告を利用しています。
どうも、こんにちは。
外資系製薬会社経営企画室に勤めるこういちです。
注目の外資系バイオベンチャーシリーズです。
今日は中国企業であるBeiGene(ベイジーン)を取り上げたいと思います。
血液がん領域での新薬の申請を控えたこの会社の将来性について調べてみました。
調べてみたところパイプラインも超魅力的なので、興味ある方は転職エージェントから情報を取ることをオススメします。
求人は【ランスタッド】から入ってきました。
少し長い記事になりましたが、最後までお付き合いください。
それではどうぞ。
BeiGene(ベイジーン)とは
中国バイオテクノロジー企業「BeiGene ベイジーン(百済神州)」
呼び名が面白いですよね。
われわれが「ペキン」(北京)といっている中国の都市の、中国語での発音が「ベイジン」なんです。
留学時代に中国の同級生が、「I’m from ベイジン(北京)in China」って言っていたのが懐かしいです。
ちなみに企業の漢字は”百済神州”
これでベイジーンって発音するんですかね。
すみません、どうでもいいプチ情報でした。
さて、ここから少し詳細を。
まずネットで調べた情報から
BeiGene (ベイジーン)は2010年に設立。革新的な分子標的薬とがん免疫治療薬の開発・商業化を専門とするバイオテクノロジー企業。中国、米国、欧州、豪州で事業を展開している。2016年、ナスダックに上場し1億8200億ドル(約200億円)を調達。わずか3年の間に株価は24ドル(約2600円)から138ドル(約1万5000円、執筆時)まで上昇。現在同社の製品ラインナップには新型の内服用低分子医薬品やモノクローナル抗体の抗がん剤などがあり、臨床試験を実施中あるいは計画中の薬品は50を超える。
36KR Japan, 2019年11月12日 https://36kr.jp/33126/
これだけ読んでもすごい会社だと言うことがわかりますね。
ということで次はBeiGeneの公式Global ホームページを見てみました。
コーポレートプレスキットという会社の情報をまとめたページがあり、ここからだいたいのことがわかります。
一言で言うと、中国の勢いのある製薬会社です。
というか、すでにGobalレベルで見ても立派な製薬会社です。
オンコロジーに特化していて、将来性も抜群。
2010年設立でここまで行けるのはすごいなと感じました。
コーポレートキットのFact sheetから抜粋した情報は以下です。
General Company Information
• Founded in 2010
• Administrative offices in Basel, Beijing and Cambridge, Mass.
• More than 9,000 employees worldwide working on 5 continents
• Publicly traded on NASDAQ, Hong Kong Stock Exchange (HKEX) and Shanghai Stock Exchange (SSE)
• Achieved $1B in product revenue in 2022
• Two internally discovered and developed cornerstone medicines, Brukinsa® (zanubrutinib) and tislelizumab
• Global R&D team of more than 900 oncology scientists, one of the largest such teams in the industry
• 60+ pre-clinical programs, the majority with first-in-class potential
• ~ 20 industry collaborations
• In-house manufacturing capabilities, with U.S. expansion under way
日本語翻訳
– 2010年設立
– バーゼル、北京、マサチューセッツ州ケンブリッジにオフィスを設置
– 世界5大陸で9,000人以上の従業員が勤務
– NASDAQ、香港証券取引所、上海証券取引所に株式を公開
– 2022年に製品売上高10億ドルを達成
– 自社創製の2つの基幹医薬品、Brukinsa® (zanubrutinib)およびtislelizumab
– 900人以上のがん専門研究者からなる、業界最大級のグローバル研究開発チーム
– 60以上の前臨床試験プログラムを有し、その大半はファースト・イン・クラスのポテンシャルを有する
– 20の業界との提携
– 自社製造能力を有し、米国での展開が進行中
BeiGene Fact Sheet https://www.beigene.com/corporate-press-kit/
すごいですよね。
2022年の売上高は、日本円だと1000億円以上。
社員数の数、そしてパイプラインの数もすごい。
パイプラインの詳細はまた後ほどお伝えしますね。
なんでいままで日本に進出してこなかったんだろうと不思議に思ってしまいました。
BeiGene Japan (ベイジーン日本法人)
次に日本法人の情報です。
BeiGene Japan合同会社として2021年1月22日に設立。
2年前に立ち上げたばかりですね。
2023年1月16日から国内所在地が新橋になっているようです。

日本法人の社長は
アダチ ススム (Adachi Susumu)さん
2022年8月に就任されたばかり。
経歴はGoogle先生に聞くと、以下のようです。
医師免許をお持ちのようですね。
- General Manager, Japan @ Beigene
- Area Immunology Head @ Abbvie
- Medical Director @ Abbvie
- Global Clinical Research Physician @ Eli Lilly and Company
まだ日本語のホームページがないので、日本法人の情報は取りにくいです。
Linked in でR&Dサイドの求人がちょくちょくあがってきますので、規模を拡大中なのでしょう。
パイプライン

さて、次はパイプラインです。
2022年の11月に株主向けに発表した資料から抜粋しました。
詳細はGlobalサイトのパイプラインのページをみてください。

(画像の解像度が低くてすみません。)
全部で15の薬剤がLate Stage(Ph3)およびEarly Stege(Ph1 およびPh2)で進行していることがわかります。
試験の数は全世界で60近く。
これだけで製薬会社で働いている人ならすごい会社だということは理解頂けると思います。
続いて、日本で開発が進んでいる薬についてです。
全部調べるのは大変なので、主たる治験(Ph3)に限定してお伝えします。
12のプログラム(Ph3)が動いていることが読み取れました。
(Ph3だけでこの数字。いや、すごいです。)
| 治験成分記号 | 対象疾患 | 開発相 | 実施予定期間 | ||
| BGB-A1217BGB-A317 | 同時放射線化学療法後に進行しなかった、局所進行、切除不能のPD‑L1発現で選定された非小細胞肺癌患者同時放射線化学療法後に進行しなかった、局所進行、切除不能のPD‑L1発現で選定された非小細胞肺癌患者 | 第Ⅲ相 | 2022/03/04 | ~ | 2027/07/31 |
| BGB-A1217 | 未治療の局所進行、切除不能の非小細胞肺癌患者 | 第Ⅲ相 | 2022/03/01 | ~ | 2025/04/30 |
| BGB-A317 | 未治療の局所進行、切除不能の非小細胞肺癌患者 | 第Ⅲ相 | 2022/03/01 | ~ | 2025/04/30 |
| BGB-A1217 | 局所進行性または転移性の固形癌及び局所進行性、切除不能、転移性の非小細胞肺癌 | 第Ⅲ相 | 2021/10/01 | ~ | 2025/10/31 |
| BGB-A317 | 局所進行性または転移性の固形癌及び局所進行性、切除不能、転移性の非小細胞肺癌 | 第Ⅲ相 | 2021/10/01 | ~ | 2025/10/31 |
| BGB-3111 | 幹細胞移植非適応の未治療マントル細胞リンパ腫 | 第Ⅲ相 | 2020/10/26 | ~ | 2026/11/30 |
| BGB-A317 | 手術不能な局所進行性又は転移性の胃腺癌又は食道胃接合部腺癌の患者 | 第Ⅲ相 | 2019/03/23 | ~ | 2021/07/31 |
| BGB-5-FU | 切除不能、局所進行再発性又は転移性食道扁平上皮がん | 第Ⅲ相 | 2019/02/28 | ~ | 2021/10/31 |
| BGB-A317 | 切除不能、局所進行再発性又は転移性食道扁平上皮がん | 第Ⅲ相 | 2019/02/28 | ~ | 2021/10/31 |
| BGB-Cisplatin | 切除不能、局所進行再発性又は転移性食道扁平上皮がん | 第Ⅲ相 | 2019/02/28 | ~ | 2021/10/31 |
| BGB-A317 | 進行性切除不能/転移性食道扁平上皮がん | 第Ⅲ相 | 2018/03/14 | ~ | 2020/07/31 |
| BGB-A317 | 切除不能HCC (BCLC ステージBまたはC) | 第Ⅲ相 | 2018/01/22 | ~ | 2021/04/30 |
引用:主たる治験情報リストから抜粋 2022年1月31日更新版

たくさんあって、全部読み込むのは大変ですね。
しかしよく見てみると、日本で実施されている試験は、以下の3成分で第3相試験が構成されていることがわかります。
- Ociperlimab BGB-A1217, TIGIT
- TislelizumabBGB-A317, PD-1
- Zanubrutinib BGB-3111, BTK
これ全部自社販促するとしたら相当大変だなと思いましたが、、、
そこはよく考えられてますね。
この中のOciperlimab (BGB-A1217)とTislelizma (BGB-A317)は、すでにNovartisが日本で商業化することが決まっているとのことです。
Novartisからそれに関する公式プレスリリースが、2022年と2021年にそれぞれでております。
Ociperlimab (BGB-A1217)に関するノバルティスのプレスリリース 2022年 1月

Tislelizmab (BGB-A317)に関するノバルティスのプレスリリース 2021年1月

とすると、自社販促の可能性が残る薬剤はBTK阻害薬ですね。
- Zanubrutinib BGB-3111 BTK阻害薬
つまり、日本の申請第一号はZanublutinibになる予定です。
これは自社販売を目論んでいると思われます。
さて、どんな薬か次の項でお伝えしていきます。
*2023年9月24日追記
上記で紹介した
Ociperlimab (BGB-A1217)
Tislelizmab (BGB-A317)
この2剤に関する権利がNovartisからBeigeneに戻ることが契約されました!!
それぞれ根拠は以下のソースです。
Ociperlimab (BGB-A1217)
Jul 18, 2023 Novartis Pressreleaseより抜粋
ociperlimab
(TIGIT inhibitor)BeiGene and Novartis entered into a Mutual Termination and Release Agreement to terminate the Option, Collaboration and License Agreement for ociperlimab effective July 10 2023
BeiGene社とNovartis社は、2023年7月10日をもってociperlimabに関するオプション契約、提携契約およびライセンス契約を終了させるための相互解約および解除契約を締結した。
Tislelizmab (BGB-A317)
BeiGene Strengthens Global Portfolio and Regains Full Rights from Novartis for Anti-PD-1 Antibody TEVIMBRA® (tislelizumab)
ベイジーン社、抗PD-1抗体TEVIMBRA®(tislelizumab)のグローバルポートフォリオを強化し、ノバルティス社から全権利を取り戻す
Sep 19, 2023 Beigene Pressreleaseより抜粋
いやはや、これまたすごい展開ですね。
自販するとしたら、血液がん部隊に加えて、固形がん部隊も必要になります。
そうすると、大量採用の道が・・・
大大大注目です!!
日本で第一号となる予定の新薬 Zanublutinib

日本での最初の申請はBTK阻害薬であるZanublutinibでまず間違いないでしょう。
医薬経済社ONLINE (1月1日) でもそのことが書かれています。
海外製品名は
「BURRUKINSA」(ブルキンサ)
海外における適応症は
①マントル細胞リンパ腫:mantle cell lymphoma (MCL)
②原発性マクログロブリン血症:Waldenström’s macroglobulinemia (WM)
③辺縁帯リンパ腫:marginal zone lymphoma (MZL)
④慢性リンパ性白血病:chronic lymphocytic leukemia (CLL)
⑤小リンパ球性リンパ腫:small lymphocytic lymphoma (SLL)
となっています。
国によって有する適応症は異なりますが、主にB細胞性腫瘍をターゲットにしている薬であることがわかります。
全世界における2022年度の「BURRUKINSA」(ブルキンサ)の売上高は約1億5550万ドルとなっています。
日本円を仮に100円だとしても、約155億円。
売れてますね。
数字の根拠は2022年3Q(11月9日)発表のBusinesswireの記事です。
- BRUKINSA product revenue totaled $155.5 million, increasing 136% globally versus the third quarter of 2021, led by growth in the U.S.(BRUKINSAの製品売上高は1億5550万ドルで、米国での成長に牽引され、世界全体で2021年第3四半期比136%増)
では日本の開発状況はどうでしょうか?
日本では主たる治験で以下が動いています。
| BGB-3111 | 幹細胞移植非適応の未治療マントル細胞リンパ腫 | 第Ⅲ相 | 2020/10/26 | ~ | 2026/11/30 |
マントル細胞リンパ腫を対象にしたPh3が動いてますね。
また2022年のASHで日本人のP1/2試験の結果が発表になっていて、ネット上でスライドの閲覧もできました。
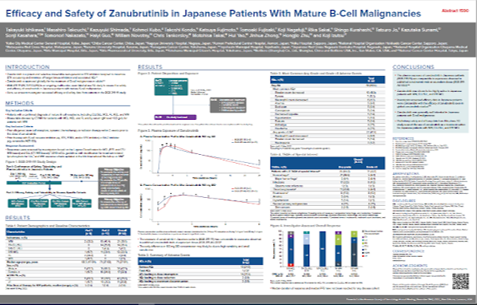
(またも画像があらくてすみません。リンクはこちら。詳しくみたい方はどうぞ。)
結果はスライドを見てもらえればわかるかと思います。
CONCLUSIONSだけ抜粋すると
- The plasma exposure of zanubrutinib in Japanese patients (BGB-3111-111) was comparable to exposures observed in published zanubrutinib trials at equivalent doses (BGB-3111-AU-003)
- Zanubrutinib was shown to be highly active in Japanese patients with WM, CLL/SLL, and R/R MCL
- Investigator-assessed efficacy data in Japanese patients were comparable with the efficacy of zanubrutinib seen in global zanubrutinib studies9-14
- Zanubrutinib was generally well tolerated in Japanese patients with B-cell malignancies
- Preliminary safety and efficacy data from this phase 1/2 study support the use of zanubrutinib as a treatment option for Japanese patients with WM, CLL/SLL, and R/R MCL
日本語訳
- 日本人患者におけるザヌブルチニブの血漿中曝露量(BGB-3111-111)は、同用量のザヌブルチニブ試験(BGB-3111-AU-003)で認められた曝露量と同等であった。
- 日本人WM患者、CLL/SLL患者、R/R MCL患者において、ザヌブルチニブが高い活性を示すことが示された
- 日本人患者における治験責任医師が評価した有効性データは、グローバルで実施されたザヌブルチニブの試験で認められた有効性と同等であった
- 日本人B細胞性悪性腫瘍患者におけるザヌブルチニブの忍容性は概ね良好であった
- この第1/2相試験の安全性と有効性の予備的データは、WM、CLL/SLL、R/R MCLの日本人患者に対する治療オプションとしてザヌブルチニブの使用を支持するものである
Presented at the American Society of Hematology Annual Meeting, December 10-13, 2022 , New Orleans, Louisiana, USA https://www.beigenemedical.com/CongressDocuments/Ishikawa_BGB-3111-111_ASH_Poster_2022.pdf
海外の結果と同様に、日本人でも同等の有効性と安全性が期待できそうですね。
こうなると申請パッケージが気になります。
最初はマントル細胞リンパ腫のみの適応で申請するのか?
それとも他国のPh3の結果を活用し、マントル細胞リンパ腫の適応以外にも広くB細胞性腫瘍の適応を取得しにいくのか?
おそらく日本人の組み入れが必要になると思うので、前者(マントル細胞リンパ腫のみでの申請)かなと思いますが、今後の申請戦略に注目です。
Zanublutinibの効果と安全性は

現在血液がんの市場では2剤のBTK阻害薬が発売になっています。
・イブルチニブ (日本ではヤンセンが発売)
・アカラブルチニブ(日本ではアストラゼネカが発売)
それと比べて有効性および安全性がどうかということですが、つい最近再発・難治例の慢性リンパ性白血病および小リンパ球性リンパ腫を対象にしたPh3試験 (ALPINE試験) の結果が判明していますね。
ケアネットでも取り上げられています。
詳細はケアネットの記事におまかせしますが、結論だけ引用させて頂くと、
再発または難治性の慢性リンパ性白血病(CLL)または小リンパ球性リンパ腫(SLL)の治療において、第2世代のブルトン型チロシンキナーゼ(BTK)阻害薬であるzanubrutinibは第1世代BTK阻害薬イブルチニブと比較して、無増悪生存期間が有意に優れ、心臓の有害事象が少ないことが、米国・ダナ・ファーバーがん研究所のJennifer R. Brown氏らが実施した「ALPINE試験」で示された。研究の成果は、NEJM誌オンライン版2022年12月13日号で報告された。
ケアネット 公開日:2023/01/05 https://www.carenet.com/news/journal/carenet/55681
簡単に言うと
・有効性/安全性ともに従来のBTKであるイブルチニブより有意さを持って勝った
という結果になりました。
現在市場を取っているのはイブルチニブ、次にアカラブルチニブですが、この2剤は有効性が同等、安全性はアカラブルチニブが勝ると言われています。
ALPINE試験ではZanublutinibがイブルチニブに比べて、有効性/安全性共に勝る結果となりました。
つまりどういうことか?
3剤の中で最も優秀な成績を収めたBTK阻害薬ということになります。
ですので、データだけで考えれば切り替えもしくは新規はすべてZanublutinibになるのではと予想します。
これだけ勝ち筋が見えている薬剤が上市されるのも珍しいと思います。
とはいえ、BeiGene (ベイジーン) はまだ日本で立ち上げたばかりで人数も少ないですし、血液学会との関係構築もこれからでしょうから、浸透には時間を要するかもしれません。
今後の展開に要注目です。
BeiGene Japanの年収や求人

実は2023年の年明けにマーケティングポジションの求人が飛び込んで来ました。
前からLinked inではRA(Regulatory Affairs)やCMC(Chemistry, Manufacturing and Control)の案件が出ていたので、そろそろコマーシャル案件も出るのではと予想していました。
案の定やってきましたね。
マーケティングで年収レンジCompetitive という形で具体的な額の提示はありませんでした。
(Manager 職なので上限は1500万円位ではと予想します。)
いまはまだ1桁の社員数とのことですが、今後1年から1年半位かけて、70名近くまで社員数を伸ばして行きたい考えがあるとのことでした。
「立ち上げ案件きたなぁ」
と思いましたね。
私も、もう少し若ければ挑戦するのもありかなぁと思いました。
70数名まで社員数を増やすとすると、恐らくこの人数であれば、自前で営業組織を立ち上げてビジネスをしていくと予想されます。
つまり、将来的にMRの求人が出てくると予想します。
薬的にはいま世の中で使える治療薬よりも効果と安全性に優れることはすでに臨床試験で証明されています。
プライマリー製品と違って、対象がオンコロジー(血液がん)なので、患者さんは少しでも効果のある薬剤を求める傾向が強くなります。
そのため、売り上げを伸ばしていくのはそんなに難しいことではないのかなと予想します。
なにせ臨床試験の結果がピカイチでしたからね。
ヤンセンでイブルチニブを、アストラゼネカでアカラブルチニブを扱っていたMarketing の方やMRの方、メディカルの方は興味深々ではと予想します。
求人は【ランスタッド】から入ってきました。
良かったら情報取ってみてください。
他からも情報ゲットできる可能性もありますので、こういちの登録している転職エージェントのリンク貼り付けておきます。
JAC Recruitment 外資系案件に強みをもっています。
エンワールド 製薬専門チームありです。
マイナビエージェント どちらかというと内資系案件が多い。
リクルートダイレクトスカウト 本社系案件に強い印象。
【ランスタッド】 外資系案件に強みを持っています。
ということで本日は以上です。
結構Rareな案件なので応募の殺到が予想されます。
今後10年で大きく伸びるポテンシャルを持っている会社です。
応募する方は頑張ってください!
それでは~~。
*2023年9月24日追記
途中にも追記しましたが、
- Ociperlimab BGB-A1217, TIGIT
- TislelizumabBGB-A317, PD-1
この2剤が新たに自販の可能性も見えてきました。
そうなると固形がん部隊が必要になります。
PD-1なので様々な固形がんへの適応が期待されます。
すでに肺がん、胃がん、扁平上皮癌のPh3が走ってます。
いまReguratolyの人を急ピッチで雇っている背景もなんとなくわかりました。
この固形がんの申請・照会事項対応のためかもしれませんね。
これはオンコロジー経験者には激熱案件ですので、絶対情報は取ったほうが良いと思います。
ということで今日の追記は以上です。
**2024年2月21日追記
第二弾の記事を書きました。良かったらご覧ください。




コメント